阳春三月,香港奥星集团整合行业最新资讯,基于EU GMP附录一的更新,针对无菌药品生产企业以及洁净工程、设备供应商展开专题分享,本次活动聚焦无菌产品生产质量管理体系的合规、设施、设备的设计、建造、调试&确认和维护等热点话题。

此次活动特别邀请到制药行业质量与合规专家Andrew Marshell、PDA TR 29号、60号技术报告编者Irwin Hirsh、洁净区无菌工艺专家Yossi Shapira、高端项目咨询顾问Ewart Richardson以及奥星集团的三位专家韩源、王建华和金磊,共七位嘉宾围绕了制药质量体系构建与设计、无菌设施设备整体规划、细胞治疗工艺控制要点、冻干污染控制策略、隔离器风险管控以及数字化知识管理的应用主题进行了详细解读,引发了在线客户积极互动。

EU GMP附录1由EMA、WHO、PIC/S三个组织联合修订,更加切合目前法规监管环境以及生产环境,同时融入技术先进性因素。遵循该指南的相关要求,既符合监管国际化的要求,更能提升企业药品质量的管理水平,从而融入国际市场。合规是保证制药企业正常运营的重中之重,而如何有效的进行无菌药品合规生产活动是构建质量体系的核心。
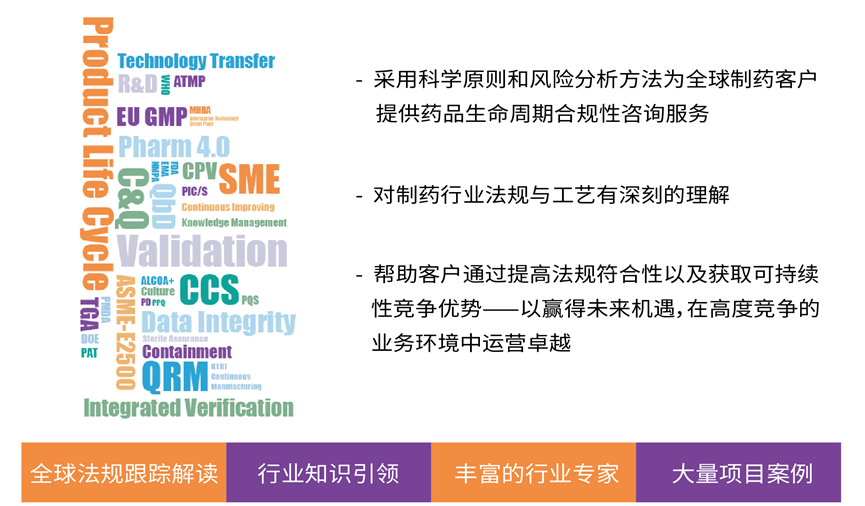
奥星作为制药工程解决方案专家,致力于推动行业进步,愿持续为制药客户提供前沿知识、先进工艺技术及合规高效的解决方案。
 关注了解更多
关注了解更多香港奥星集团
免责声明 隐私条款 Copyright © AUSTAR All Rights Reserved 沪ICP备2020038190号-3